【高校化学基礎】「酸と塩基の価数と強弱」 映像授業のTry IT (トライイット)
更新日: 2022-01-04. 理科の実験. 炭酸水素ナトリウムの水溶液が塩基性(アルカリ性)になるのは、炭酸水素イオン(HCO3-)が水と反応して炭酸を形成し、その過程で水酸化物イオン(OH-)が放出されるためです。. 炭酸水素ナトリウムを水に溶かす.
炭酸水素ナトリウムと炭酸ナトリウムはなぜ性質が違うのか 優しく解説|マチョスLab
正塩. 《 塩の水溶液の性質》正塩, 酸性塩, 塩基性塩という塩の分類は,その塩の水溶液が実際に示す性質とは必ずしも一致しない。 例えば, 硫酸水素ナトリウムNaHSO4 と炭酸水素ナトリウムNaHCO3はともに酸性塩であるが,NaHSO4 の水溶液は酸性を示し,NaHCO3 の水溶液は塩基性を示す。正塩の水溶液の性質は, その塩をつくるもととなった酸・ 塩基の強弱によって決まる 。 例えば,酢酸ナトリウムCH3COONa は正塩であるが, 水溶液は塩基性を示す。 強酸+ 強塩基→ 塩.. 水溶液は中性. ★強酸と強塩基でできた酸性塩の. 強酸+ 弱塩基→ 塩.. 水溶液は酸性. 水溶液は,さらに電離するため. 弱酸+ 強塩基→ 塩.. 水溶液は塩基性. 酸性を示す。

中学2年 理科『炭酸水素ナトリウムの熱分解』【現役教師による授業動画】 YouTube
acid salt. 塩 ( えん )の うち 、酸成分の一部の 水素原子 だけが陽性成分によって置換され、一部の水素原子がそのまま残っているものの 通称 。 正しくは水素塩という。 ただし酸性塩といっても 水溶液 が酸性であるとは限らない。 たとえば、硫酸H 2 SO 4 やリン酸H 3 PO 4 などの 二塩基酸 、 三塩基酸 では、水酸化ナトリウムNaOHで中和すると、硫酸水素ナトリウムNaHSO 4 のような酸性塩と 正塩 である硫酸ナトリウムNa 2 SO 4 、またリン酸二水素一ナトリウムNaH 2 PO 4 やリン酸一水素二ナトリウムNa 2 HPO 4 のような酸性塩とリン酸ナトリウムNa 3 PO 4 のような正塩が得られる。
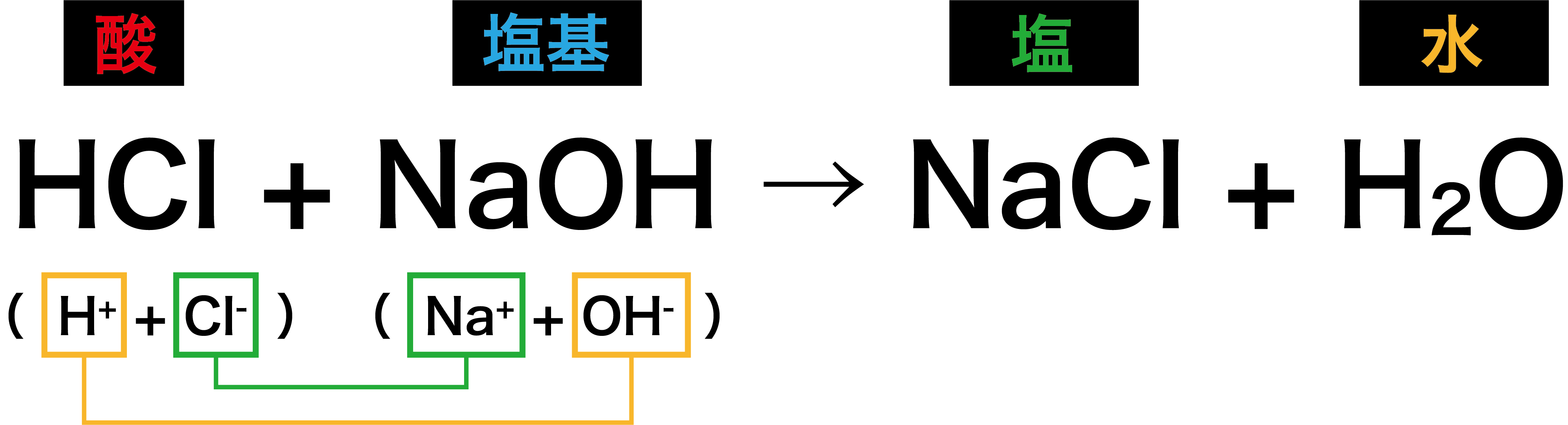
中和で「塩」と「水」ができる化学反応式がスグわかる!【中3化学】 理科の授業をふりかえる
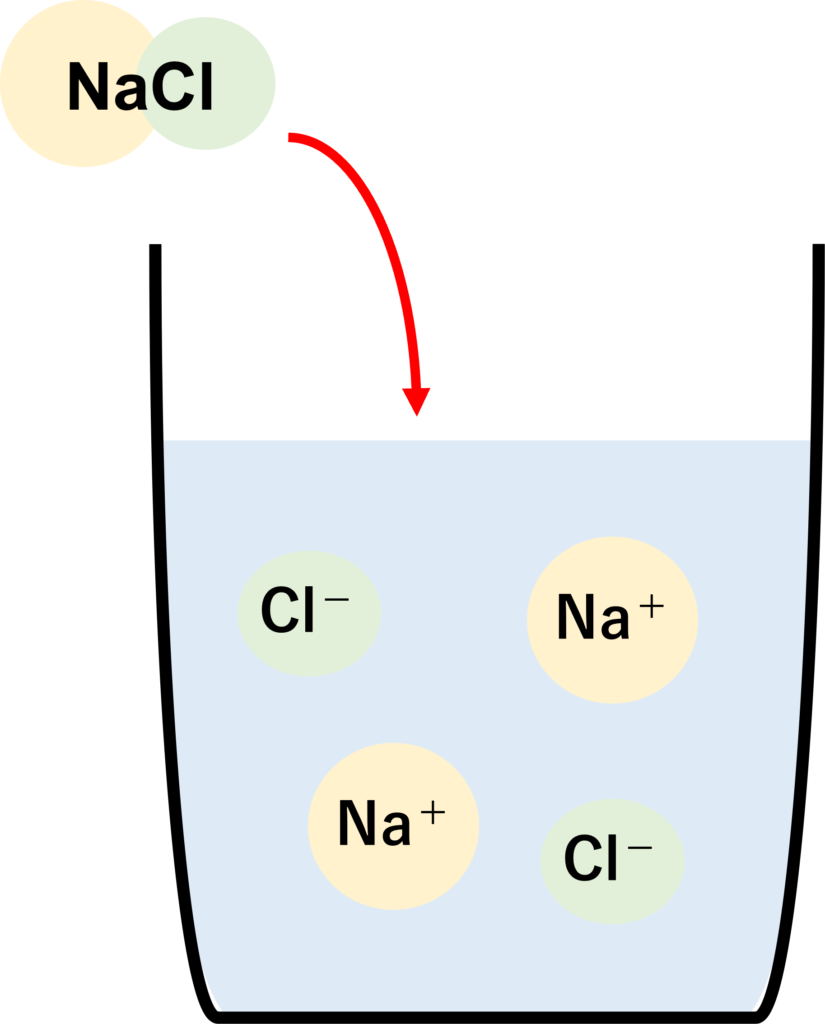
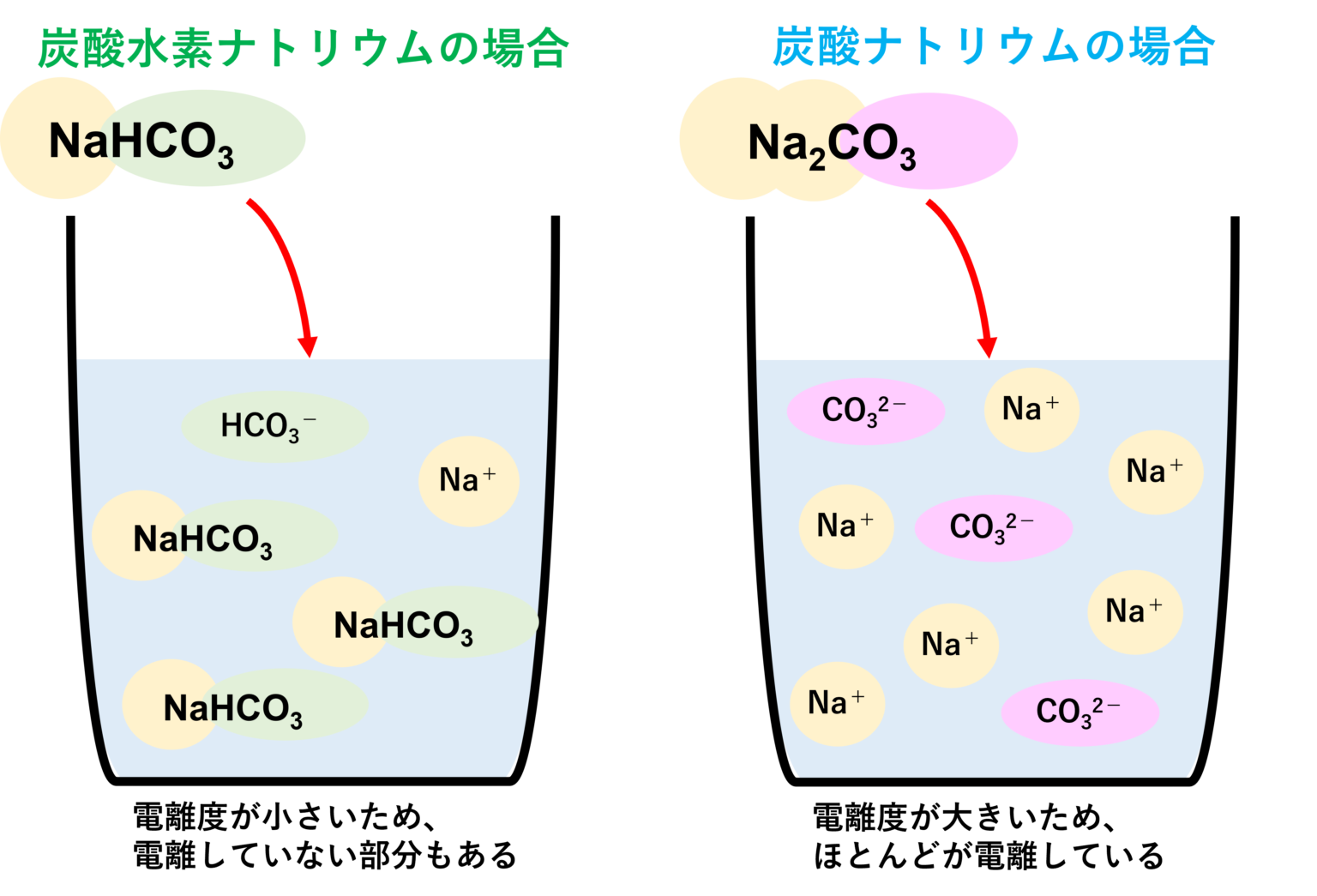
性質の違い. 炭酸水素ナトリウム と 炭酸ナトリウム の主な性質の違いは2つで、 ・水への溶けやすさ. ・アルカリ性の強さ. です! そして、 炭酸ナトリウム のほうが水に溶けやすく、アルカリ性が強いです! 水への溶けやすさはなぜ違うか. 物質が水に溶ける仕組み. そもそも物質が水に溶けるとはどうゆう意味でしょうか。 それは、 「物質が水中でばらばらになる (イオンになる)」 ということです。 (一部例外あり) 例えば、食塩 (NaCl)が水に溶ける時、 NaCl→Na + +Cl -. という式で表されるように、NaClはナトリウムイオンと塩化物イオンに分かれ、その結果水に溶けます。 このように 物質が水中でイオンに分かれることを「電離」 といいます。 ここがポイント!

中2理科「炭酸水素ナトリウムの熱分解」塩化コバルト紙や実験の注意点 Pikuu
〘名〙 炭酸 に含まれる二個の 水素原子 の うち 、一個を金属類で置換してできる塩の 総称 。 化学式 M I HCO 3 溶液 としては多くのものが知られるが、固体としてとり出せるものはナトリウム塩、カリウム塩、アンモニア塩などで余り多くない。 固体は 加熱 によって 二酸化炭素 を放って 炭酸塩 にかわる。 重炭酸塩 。 酸性炭酸塩。 出典 精選版 日本国語大辞典精選版 日本国語大辞典について 情報. 化学辞典 第2版 「炭酸水素塩」の解説. 炭酸水素塩. タンサンスイソエン. hydrogencarbonate.
炭酸水素ナトリウムと炭酸ナトリウムはなぜ性質が違うのか 優しく解説|マチョスLab
2 回答. 「炭酸水素ナトリウムは酸性塩に分類されるが、 水溶液は塩基性を示す。. 」 炭酸水素ナトリウムが酸性塩なのは わかるのですが、 (NaHCO3で、Hが入っているから、ですよね?. ) なぜ水溶液が塩基性を示すのですか?. 補足. ありがとうござい.

√100以上 炭酸 ナトリウム 塩酸 185956
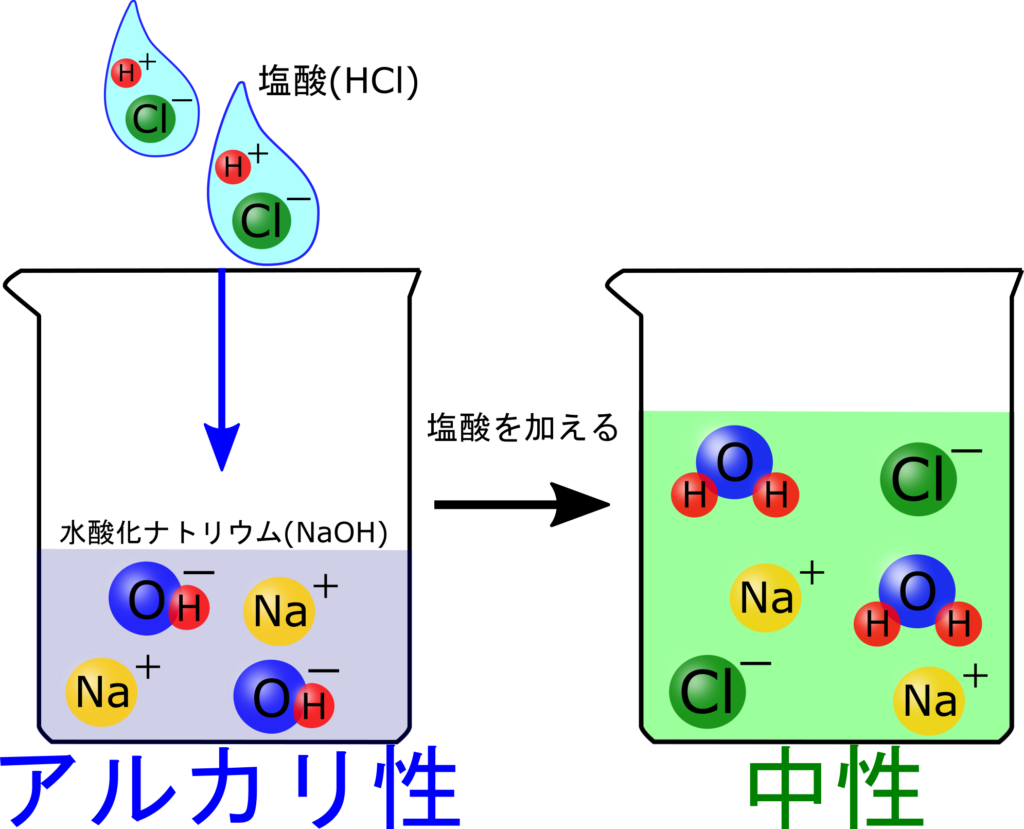
HCl + H 2 O → H 3 O + + Cl -. またアンモニアが水と反応するとH + を受け取ることによってNH 4+ となります。 そのためアンモニアは塩基です。
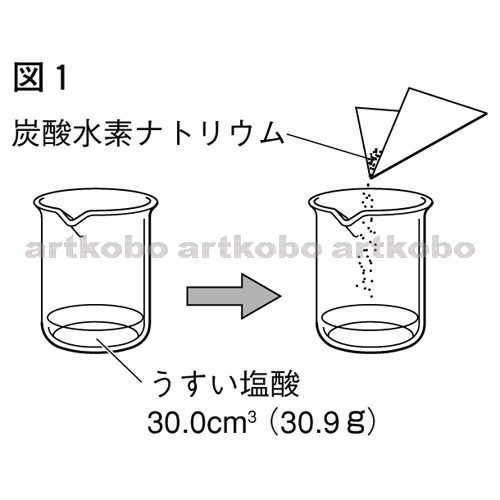
Web教材イラスト図版工房 / 理_07_長野_問_03_01
塩の分類. 中和の結果生成する"塩"には酸性塩・塩基性塩・正塩の3種類存在する。 酸由来のH + が残っている塩を 酸性塩 という。 具体例としては、NaHCO 3 (NaとCの間のH)・NaHSO 4 (NaとSの間のH)などが挙げられる。 塩基由来のOH ー が残っている塩を 塩基性塩 という。 具体例としては、CuCl (OH)・MgCl (OH)などが挙げられる。 余分なH + やOH ー が残っていない塩を 正塩 という。 具体例としては、NaCl・CaCl 2 ・CH 3 COONaなどが挙げられる。 参考: 中和(定義・塩・中和反応式の作り方など) 塩の分類と液性. 塩の種類と、その塩を水に溶かしたときの"液性(酸性or塩基性or中性)"は必ずしも一致するわけではない。
中和(定義・塩・中和反応式の作り方など) 化学のグルメ
炭酸水素ナトリウム (たんさんすいそナトリウム、 英: sodium hydrogen carbonate )、別名 重炭酸ナトリウム (じゅうたんさんナトリウム、 英: sodium bicarbonate 、ソディウム バイカーボネイト、ビカ、重炭酸曹達(ソーダ)、略して 重曹 とも)は、 化学.
中学2年 炭酸水素ナトリウムと塩酸の反応 中学理科応援「一緒に学ぼう」ゴッチャンねる
塩の液性. 塩の種類と液性の関係は次の通りである。. 液性(=塩を水に溶かした水溶液の性質)には「中性」「酸性」「塩基性」の3種類がある。. 強酸+強塩基でつくられた正塩を溶かした水溶液の液性は「中性」、強酸+強塩基でつくられた酸性塩を.
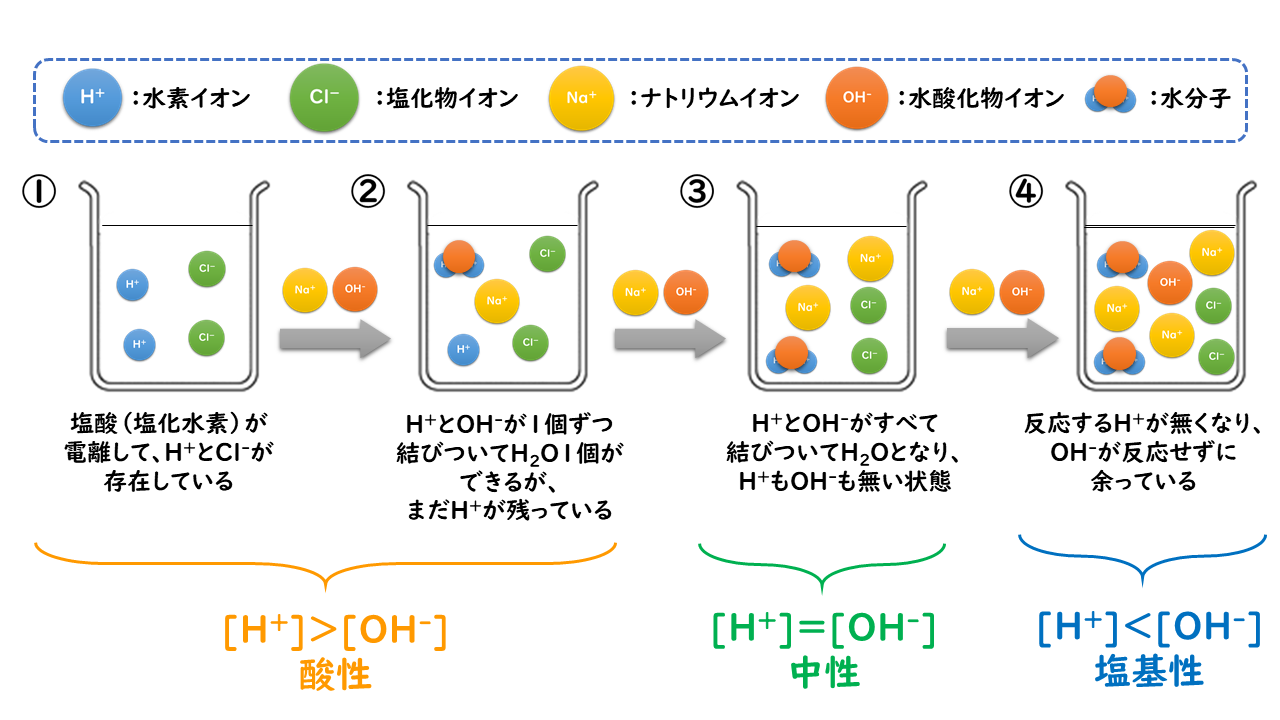
63. 中和反応|おのれー|note
酸性塩とは、 化学式中に、電離によってH+になることができる酸のHが残っている塩 のことです。. NaHCO 3 (炭酸水素ナトリウム)、NaHSO 4 (硫酸水素ナトリウム)、NaH 2 PO 4 (リン酸二水素ナトリウム)、Na 2 HPO 4 (リン酸一水素ナトリウム)など.

【この2つは絶対暗記!】酸性塩の液性の決め方 硫酸水素ナトリウムNaHSO₄と炭酸水素ナトリウムNaHCO₃の液性 塩化アンモニウムとリン酸カリウム コツ化学基礎 nahco3 塩基 性に
すべての質問を表示. 炭酸水素ナトリウム (たんさんすいそナトリウム、 英: sodium hydrogen carbonate )、別名 重炭酸ナトリウム (じゅうたんさんナトリウム、 英: sodium bicarbonate 、ソディウム バイカーボネイト、ビカ、重炭酸曹達(ソーダ)、略して 重曹.

〔高校化学〕酸性塩と水溶液(加水分解)-オンライン無料塾「ターンナップ」- YouTube
炭酸水素ナトリウムの方が水に溶けにくい 炭酸水素ナトリウム水溶液は弱塩基性,炭酸ナトリウム水溶液は塩基性. 233. <塩の加水分解> 1-1 表中の塩 (1)~ (7)をそれぞれ小さじ1杯ずつ試験管に取り,水道水3mLを加えて溶かす。 1-2 ガラス棒を用いて (1)~ (7)の水溶液を万能pH試験紙につけ,各水溶液のpHを調べる。 1-3 BTB溶液を1~2滴ずつ (1)~ (7)の水溶液に加える。 塩の種類. 化学式. 塩の分類. pH. BTB溶液の変化. 液性. (1)硫酸アルミニウム. (2)塩化アンモニウム. (3)塩化ナトリウム. (4)酢酸ナトリウム. (5)炭酸ナトリウム. (6)炭酸水素ナトリウム. (7)硫酸水素ナトリウム. 塩の種類. 化学式. 塩の分類. pH.

炭酸水素ナトリウムを水に溶かすとアルカリ性になる理由(中学校理科) YouTube
たんさんすいそ‐ナトリウム【炭酸水素ナトリウム】. 〘名〙 (ナトリウムはNatrium) ナトリウムの 炭酸水素塩 。. 化学式 NaHCO 3 白色で、 単斜晶系 の微細な結晶。. アンモニアソーダ法 による炭酸ナトリウム製造の 中間生成物 として得られる。. 水に溶け.
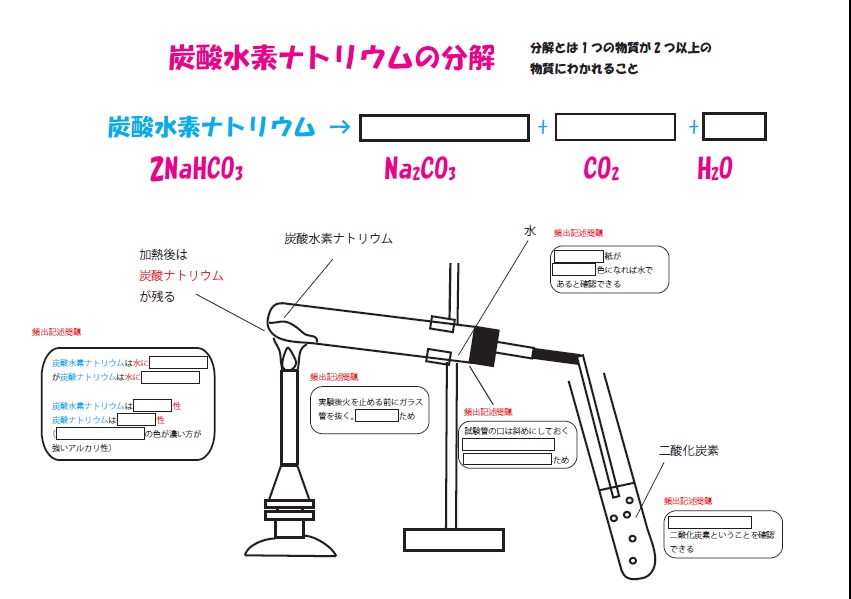
炭酸水素ナトリウムの分解 ブリッジぷりんと
例えば酸性塩である硫酸水素は酸性の水溶液になりますが、炭酸水素は塩基性を示します。 また、正塩である酢酸ナトリウムは塩基性の水溶液になります。 ちょっとやっかいです。 どう判断すればいいのか? ではそれぞれ覚えなければいけないのでしょうか?

炭酸水素ナトリウム 加熱前後の水への溶けやすさ YouTube
これも、 炭酸水素ナトリウムNaHCO 3 という立派な塩なのです。 塩には色々な種類がありますが、大きく3つに分類することができます。 今回は、この分類について、学習しましょう。 HもOHも残っていなければ正塩. 1つ目のグループは、 「正塩」 です。 正塩には、NaClやCH 3 COONaなどがあります。 これらの特徴がわかりますか? 正塩とは、 酸のHも塩基のOHも残っていない ものなのです。 ちなみに、CH 3 COONaの「H 3 」の部分は電離しないため、考える必要はありません。 Hが残っていれば酸性塩. 2つ目のグループは、 「酸性塩」 です。 酸性塩には、Na H CO 3 やNa H SO 4 などがあります。 酸性塩の特徴は、 酸のHが残っている ということです。